Einloggen
oder per Benutzername oder E-Mail-Adresse:
EinloggenWähle Deine Cookie-Einstellung
Einloggen
oder per Benutzername oder E-Mail-Adresse:
EinloggenKontakt
Ihr Name:
Ihre E-Mail-Adresse:
Ihre Anfrage:
Kategorien
Kategorien auswählen
Karte an Position verschieben
Karten-Feedback
Schreibe direkt an den Autor der Karteikarte: Deine Anmerkungen, Ergänzungen und Korrekturen.
Eine Urheberrechtsverletzung melden
Bitte gib mindestens einen Link zu einer Quelle an, mit der wir überprüfen können, ob Deine Beschwerde berechtigt ist!
Bitte gib uns Deine Kontaktinformationen (wie Telefonnummer oder E-Mail-Adresse), so dass wir Dich für Rücksprache kontaktieren können, falls nötig.
Verschieben
Verschiebe die Karte in einen anderen Kartensatz.
Zielkartensatz:
Position:
Kopieren
Kopiere die Karte in einen anderen Kartensatz.
Zielkartensatz:
Position:
Mehrere neue Karten
Anzahl neue Karten:
Lernstufe
Setze eine neue Lernstufe für die Karte. Warnung: Hiermit kann man den Lernplan auf eine Weise ändern, die den Lernerfolg beeinträchtigen kann.
Lernstufe:
Kartensatz empfehlen
Empfiehl den Kartensatz weiter.
Einbetten
Nutze den folgenden HTML-Code, um den Kartensatz in andere Webseiten einzubinden. Die Dimensionen können beliebig angepasst werden.
<iframe src="https://www.repetico.de/cardset-784723" height="400" width="400" style="padding:4px;background-color:#007356;"></iframe>
Exportieren
Wähle das Format für den Export:
Datei für Import hochladen
Gültige Dateiformate:
Wähle das Format der einzelnen Karten auf dem Papier:
Test erstellen
Erstelle Vokabeltests oder Aufgabenblätter zum Ausdrucken.
Wähle ein Layout, das zum Inhalt der Karteikarten passt. Verwende das erstellte Dokument als Basis zur Weiterverarbeitung.
Layout:
Lernzieldatum festlegen
Kartensatz löschen
Willst du den ausgewählten Kartensatz wirklich löschen?
Die Wasserstoffionenzentrationen in wässrigen Lösungen sind kleine Werte
Um die sauren bzw. basischen Eigenschaften von wässrigen zu erfassen, wurde der pH-Wert definiert. → dieser beschreibt mit Zahlen die saure, neutrale oder basische Reaktion einer Lösung
In Abb.1 sind die Konzentrationen und die resultierenden pH-Werte dargestellt -> Rechnerisch stellt er den negativen dekadischen Logarithmus der H+-Konzentration dar:
pH = - log [H+]
Neben dem pH-Wert existiert auch der pOH-Wert mit: pOH = - log [OH-]
Bei 25 °C gilt: pH + pOH = 14,00
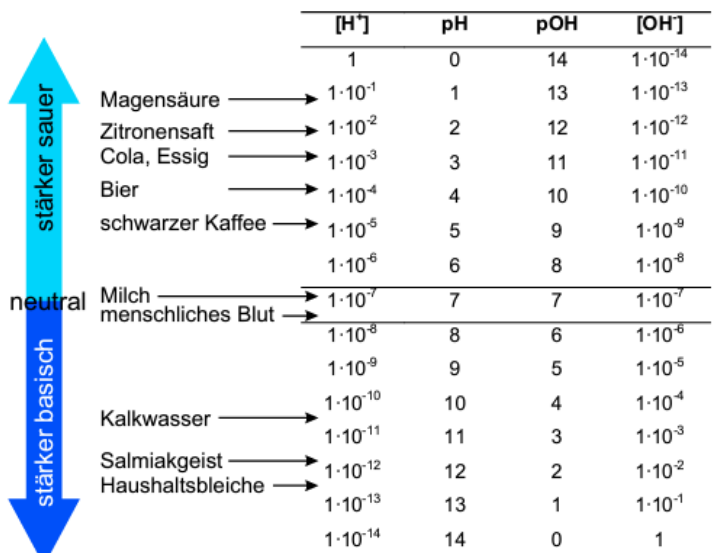
Abb. 1: H+ - und OH-Konzentrationen einiger gebräuchlicher Substanzen bei 25°C mit den entsprechenden pH- und pOH-Werten
Diskussion